베이진, ‘브루킨사’ WM 환자 치료제로 호주 당국 1차 승인
10월 1일 외투세포림프종 치료제로 브루킨사 승인한 싱가포르에 이어 아태 지역서 2번째 승인 확보
TGA, 이브루티닙과 비교·평가한 ASPEN 임상 시험을 통해 드러난 효능을 기반으로 브루킨사 승인
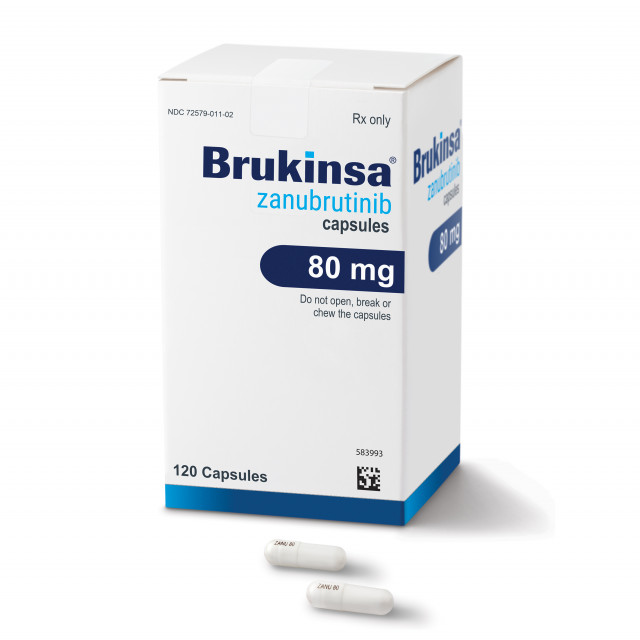
시드니/캠브리지, 매사추세츠/베이징--(뉴스와이어)--혁신적이고 저렴한 의약품을 개발해 전 세계 환자들에게 공급, 치료 결과를 개선하는 과학 기반 글로벌 바이오테크놀로지 기업 베이진(BeiGene)(나스닥: BGNE; 홍콩증권거래소: 06160)이 자사의 브루킨사(BRUKINSA®)(성분명: 자누브루티닙(zanubrutinib))가 최소 1회 치료 요법을 받은 적이 있거나 치료 요법을 받은 적은 없지만, 화학 면역 요법[1]이 부적합한 성인 마크로글로불린혈증(Waldenström’s macroglobulinemia, WM) 환자 치료제로 호주 당국의 승인을 받았다고 7일 발표했다.
앞으로 호주 의약품규제기관인 TGA(Therapeutic Goods Administration)의 허가를 받으면 베이진이 주관하는 선구매·후상환 프로그램을 통해 WM 환자들이 즉시 브루킨사를 살 수 있을 것으로 예상된다.
한편 싱가포르 보건과학청(HSA)도 최소 1회 치료 요법을 받은 성인 외투세포림프종(MCL) 환자 치료제로 브루킨사를 승인했다.
피터맥컬럼암센터(Peter MacCallum Cancer Centre)의 저등급림프종(LGL) 및 만성림프구백혈병(CLL) 질병 그룹 총괄이자 브루킨사 임상 프로그램을 이끈 연구원인 콘 탐(Con Tam) 교수는 “BTK 억제는 WM 환자를 위해 자리를 잡은 치료 방식으로 ASPEN 임상에 따르면 브루킨사는 1세대 BTK 억제제보다 효능과 내약성이 뛰어나다”며 “베이진은 2013년에 호주에서 첫 브루킨사 임상 시험을 시작했고, 이후 임상 과정에서 많은 호주인에게 도움을 줬다”고 말했다. 이어 “호주 WM 환자에게 브루킨사가 새로운 희망이 되길 기대한다”고 덧붙였다.
호주에서 비호지킨림프종(NHL)은 성인[2]에게 가장 흔한 6번째 암으로 매년 6000명 이상이 NHL 진단을 받는다. WM은 진행 속도가 느리고 , 희귀한 림프종으로 전체 NHL[3] 환자 가운데 WM 환자가 차지하는 비중은 채 2%가 되지 않는다. WM은 보통 노인이 걸리는 질병으로 주로 골수에서 발견되지만, 림프절과 비장[3]에도 영향을 미칠 수 있다.
호주 WM 환자들에게 지원과 정보를 아끼지 않는 비영리 기구 WM오지스(WMozzies)의 데이비드 영(David Young)은 “WM은 진행 속도가 느린 림프종으로 모든 환자에게 적용할 수 있는 치료 요법은 존재하지 않으며, 부작용 때문에 치료를 중단하는 사례가 많다”며 “임상 시험을 통해 호주 WM 환자들의 치료 결과를 개선할 가능성을 입증한 차세대 BTK 억제제를 구입할 수 있게 됐다는 소식을 접해 기쁘다”고 말했다.
베이진은 호주 의약품급여자문위원회 PBAC(Pharmaceutical Benefits Advisory Committee)의 WM 상환 검토 절차를 밟고 있다. 검토가 끝나면 PBAC 최초로 WM 증상 등재일을 모색하기 위한 경로를 밟을 수 있을 것으로 예상된다.
제인 황(Jane Huang) 베이진 혈액학 최고의료책임자는 “브루킨사는 깊고 오래 가는 반응을 유도해 비표적 부작용을 줄인다”며 “표준형 BTK 억제 요법보다 임상 효과가 개선됐음을 시사하는 대목”이라고 말했다. 이어 “임상 시험에 참여해 TGA 승인에 기여한 호주 연구원, 환자, 가족들에게 감사드린다”며 “브루킨사를 호주 WM 환자들에게 제공해 더 저렴한 종양 치료제를 전 세계에 공급한다는 목표에 한 걸음 다가설 수 있게 됐다”고 덧붙였다.
아담 로치(Adam Roach) 베이진 아태(전 중화권) 영업 총괄 겸 부사장은 “싱가포르를 잇는 호주 당국의 승인은 브루킨사가 아태 지역에서 꾸준히 입지를 늘리고 있음을 보여준다”며 “베이진은 잠재적으로 같은 급 최고의 BTK 억제제인 브루킨사를 전 세계 환자들에게 제공한다는 목표를 뒷받침하기 위해 아태 지역에서 영업팀을 구축해 왔다”고 말했다.
호주 당국은 MYD88 돌연변이(MYD88MUT)가 있는 재발·불응성(R/R) 또는 치료 경험이 없는 WM 성인 환자를 대상으로 이브루티닙(ibrutinib)과 비교·평가한 무작위 ASPEN 임상 3상(NCT03053440)을 통해 드러난 효능을 기반으로 브루킨사를 승인했다. 임상 시험에 따르면 브루킨사의 VGPR(28.4%, 95% CI: 20, 38)은 이브루티닙(19.2%, 95% CI: 12, 28)보다 높았다. 다만 깊은 반응과 관련된 통계적 우월성에 대한 1차 평가 지표는 달성하지 못했다.
ASPEN 임상 시험에 참가해 브루킨사를 투여받은 무작위 WM 환자 101명 가운데 5%가 심비대, 호중구 감소증, 다발성 골수종, 경막하 출혈 등의 부작용으로 실험을 중단했다. 또 14.9%는 부작용으로 투여량을 줄였다. 이들 환자에게 발생한 가장 일반적인 부작용은 호중구 감소증(3.0%)과 설사(2.0%)였다.
브루킨사의 전반적 안전성 프로파일은 임상 시험에서 브루킨사 치료를 받은 B세포 악성 종양 환자 799명의 통합 데이터를 기반으로 한다. 브루킨사와 관련된 가장 일반적인 부작용(20% 이상)은 호중구 감소증, 혈소판 감소증, 상기도 감염, 출혈·혈종, 발진, 타박상, 빈혈, 근골격 통증, 설사, 폐렴, 기침 등이었다. 가장 일반적인 중증(Grade 3) 이상의 부작용(5% 이상)은 호중구 감소증, 혈소판 감소증, 폐렴, 빈혈 등이었다.
식사 전후로 160mg씩 1일 2회 혹은 1일 1회 320mg 경구 복용을 권장한다. 복용량은 부작용에 따라 조절할 수 있으며, 간 손상이 심각하거나 특정 약물 상호 작용을 보이는 환자의 경우 복용량을 줄일 수 있다.
브루킨사(BRUKINSA®)(성분명: 자누브루티닙(zanubrutinib)) 개요
브루킨사는 베이진 과학자들이 발견한 저분자 BTK(Bruton’s tyrosine kinase) 억제제로 전 세계에서 다양한 B세포 악성 종양 치료 요법과 결합한 통합 요법이나 단일 요법으로 임상 과정을 밟고 있다. 새로운 BTK가 끊임없이 합성된다는 점을 고려해 BTK 단백질을 완벽하고 지속 가능하게 억제할 수 있도록 생체 이용률, 반감기, 선택성을 최적화했다. 브루킨사는 검증을 마친 여느 BTK 억제제와는 다른 약물 동태학을 바탕으로 많은 질병 관련 세포 내 악성 B셀의 증식을 억제하는 것으로 확인됐다.
브루킨사는 미국, 중국, 호주, 캐나다 등에서 치료제로 승인받았고 그 밖의 다른 국가에서도 승인 절차를 밟고 있다.
베이진 종양학
베이진은 혈액학, 면역 항암제, 표적 치료 요법을 발전시켜 효과적이고 저렴한 치료제를 세계 전역 환자들에게 공급하기 위해 매진한다. 약 2300명의 연구·개발 직원을 보유하고 있으며 이들 직원을 통해 1만3000명이 넘는 환자와 건강한 피험자를 대상으로 90건을 웃도는 임상 시험을 전개했다. 대부분 회사 소속인 임상 개발 직원들이 약 40개 국가 및 지역에서 임상 시험을 지원하고, 베이진의 광범위한 포트폴리오를 관장하고 있다. 현재 베이진은 회사 연구소를 통해 발견·개발한 브루킨사, 티스렐리주맙(Tislelizumab), 파미파립(Pamiparib)을 판매하고 있다. BTK 억제제인 브루킨사는 미국, 중국, 캐나다 등 여러 해외 시장에서 판매되고 있고, 비FC감마 수용체 겸 항PD-1 항체인 티스렐리주맙과 PARP 억제제 파니파립은 중국에서 판매되고 있다. 베이진은 품질과 혁신을 바탕으로 중국 과학·의약품 업계를 선도하고 있다.
베이진은 글로벌 의료 수요를 해소할 치료 요법을 개발한다는 목표를 공유하는 혁신적인 기업들과 파트너십도 맺었다. 베이진은 암젠(Amgen) 및 브리스톨마이어스스큅(Bristol Myers Squibb)과 라이선스를 체결해 다양한 종양 치료제를 중국에 판매하고 있다. 또 암젠, 바이오테라(Bio-Thera), EUSA파마(EUSA Pharma), 미라티테라퓨틱스(Mirati Therapeutics), 시젠(Seagen), 자임웍스(Zymeworks) 등의 협력사와 함께 판매 지역을 전 세계로 넓혀 나갈 계획이다. 베이진은 노바티스(Novartis)와 협력 협약을 체결해 북미, 유럽, 일본에 티스렐리주맙을 개발·제조·판매할 수 있는 권리를 부여했다.
베이진(BeiGene) 개요
베이진은 혁신적이고 저렴한 의약품을 개발해 전 세계 환자들에게 공급, 치료 결과를 개선하는 과학 기반 글로벌 바이오테크놀로지 기업이다. 40건이 넘는 임상 후보로 구성된 폭넓은 포트폴리오를 바탕으로 자체 역량과 협력을 통해 신약 파이프라인 개발을 앞당기고 있다. 베이진은 2030년까지 20억명 이상의 사람들이 의약품을 살 수 있도록 접근성을 신속히 개선하기 위해 매진하고 있다. 5대주에 7000명 이상의 베이진 직원들이 근무하고 있다. 웹사이트(www.beigene.com.au)나 트위터(@BeiGeneGlobal)에서 베이진에 대한 더 자세한 정보를 확인할 수 있다.
미래예측진술
이 보도자료는 1995년 제정된 증권민사소송개혁법이나 기타 연방 증권법에 따른 미래예측진술을 포함하고 있다. 호주, 싱가포르, 아태 지역 등에서 브루킨사의 개발 및 판매 계획에 대한 진술, 브루킨사의 잠재적 상업화에 기회에 대한 진술, 호주 환자를 대상으로 한 브루킨사 판매 계획에 대한 진술, 브루킨사가 동급 최고의 BTK 억제제로 부상하고 환자에게 개선된 임상 효과를 제공한 가능성에 대한 진술, ‘베이진 종양학’과 ‘베이진 개요’에서 다룬 베이진의 계획, 노력, 목표 등에 대한 진술이 미래예측진술에 해당한다. 미래예측진술은 다양한 요인의 영향을 받기 때문에 실제 결과는 미래예측진술로 그린 결과와 크게 다를 수 있다. 베이진이 약물 후보의 효능과 안전성을 입증하는 역량, 약물 후보의 임상 결과에 따른 추가 개발 지원 및 마케팅 승인 미비, 임상 실험과 마케팅 개시·시기·전개에 영향을 미칠 수 있는 규제 당국의 조처, 승인 이후 베이진이 표적 약물과 약품 후보의 상업적 성공을 달성하는 역량, 베이진이 의약품 및 기술에 대한 지식 재산권을 확보하고 보호하는 역량, 제품 개발과 제조, 기타 서비스에 대한 베이진의 제3자 의존도, 규제 기관의 승인 확보 및 의약품 상업화에 대한 한정적 경험 및 추자 재원 조달 역량, 코로나19 팬데믹이 베이진의 임상 개발, 승인, 상업화, 운영 등에 미치는 영향 등을 예로 들 수 있다. 베이진이 미 증권거래위원회(SEC)에 제출한 10-Q 양식의 보고서에 이런 요소와 잠재적 위험, 불확실성 등이 자세히 기재돼 있다. 이 보도자료에 기재된 모든 정보는 보도자료 작성일을 기준으로 한다. 베이진은 법이 요구하지 않는 한 정보를 업데이트할 의무를 지지 않는다.
참조:
[1] 브루킨사 호주 제품 정보. 웹사이트(https://www.beigene.com.au/PDF/BRUKINSAAUPI.pdf)에서 확인 가능. 2021년 10월.
[2] https://www.lymphoma.org.au/types-of-lymphoma/non-hodgkin-lymphoma. 2021년 8월.
[3] https://www.lls.org/sites/default/files/2021-07/FS20_Waldenstrom_FactSheet_2021.pdf. 2021년 8월.
비즈니스와이어(businesswire.com) 원문 보기: https://www.businesswire.com/news/home/20211007005999/en/
[이 보도자료는 해당 기업에서 원하는 언어로 작성한 원문을 한국어로 번역한 것이다. 그러므로 번역문의 정확한 사실 확인을 위해서는 원문 대조 절차를 거쳐야 한다. 처음 작성된 원문만이 공식적인 효력을 갖는 발표로 인정되며 모든 법적 책임은 원문에 한해 유효하다.]